_ بخش باتری ها و پیل های اِلکتریکی
باتری (سلول های خشک و مرطوب) ساختار ، عملکرد و کاربرد های باتری
پژوهشگر و نویسنده: ( افشین رشید )
نکته: وظیفه یک باتری تامین و توزیع انرژی و سپس تخلیه آن با تبدیل انرژی شیمیایی به جریان الکترونیکی میباشد . باتری های معمولی اغلب با استفاده از یک یا چند سلول الکتروشیمیایی با استفاده از مواد شیمیایی برق تولید می کنند .
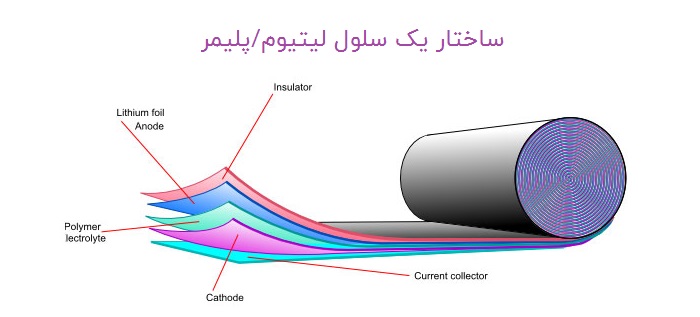
بسیاری از مواد مختلف در باتری ها مورد استفاده و استفاده قرار می گیرند ، اما انواع باتری متداول آن قلیایی ،لیتیوم_ یون و لیتیوم پلیمر ، هیدرید نیکل _ فلز است . باتری ها را می توان در مدار سری یا مدار موازی به یکدیگر وصل کرد.باتری های متنوعی وجود دارد و از این نوع باتری های مختلف در دستگاه های مختلف استفاده می شود. از باتری های بزرگ برای شروع اتومبیل استفاده می شود و باتری های کوچکتر به طور کلی ، باتری ها در زندگی روزمره بسیار مهم هستند.یک سلول واحد واحد است که از طریق برخی روش ها برق تولید می کند. به طور کلی ، سلول ها از طریق یک فرآیند حرارتی ، شیمیایی یا نوری ، نیرو تولید می کنند.برخی اصطلاحات منحصر به فرد وجود دارد که ویژگی های باتری مانند وات ساعت (میلی آمپر ساعت) ، درجه بندی C ، ولتاژ اسمی ، ولتاژ شارژ ، شارژ را تعریف می کند. جریان ، جریان تخلیه ، قطع ولتاژ ، ماندگاری ، عمر چرخه معدود اصطلاحاتی است که برای تعریف عملکرد باتری استفاده می شود.
سلول باتری
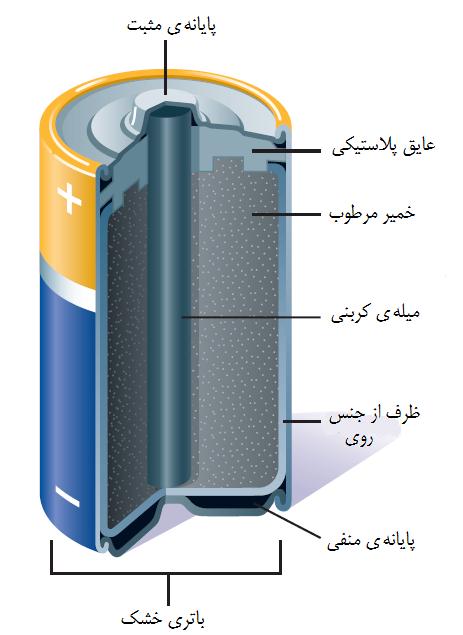
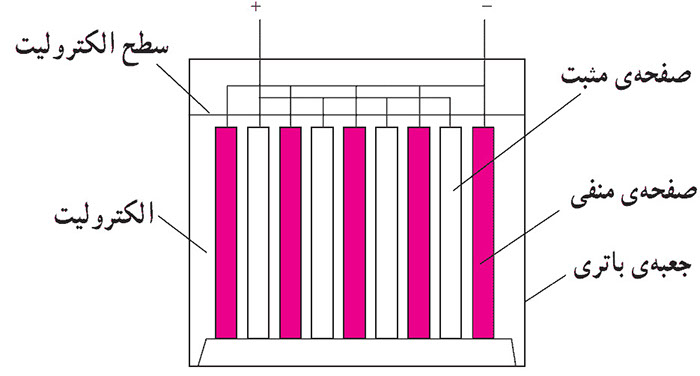
سلول معمولی دارای دو پایانه است (که به آن الکترود گفته می شود ) که در یک ماده شیمیایی غوطه ور است به آن الکترولیت گفته میشود. این دو الکترود توسط یک دیوار یا پل متخلخل از هم جدا شده اند که اجازه می دهد تا بار الکتریکی از یک طرف به طرف دیگر از طریق الکترولیت عبور کند. آند - ترمینال منفی - الکترون را به دست می آورد در حالی که کاتد - ترمینال مثبت - الکترون ها را از دست می دهد. این تبادل الکترون ها باعث ایجاد اختلاف در اختلاف پتانسیل یا ولتاژ بین دو ترمینال می شوند. در یک باتری ، تعداد زیادی سلول در یک باتری وجود دارد.
سلولهای اولیه ("خشک")
در این سلولها یک عمل شیمیایی بین الکترود و الکترولیت باعث تغییر دائمی می شود ، به این معنی که قابل شارژ نیستند . این باتری ها یکبار مصرف هستند ، که باعث می شود پس از مدت زمان نسبتاً کوتاهی از دفع این باتری ها تلف شود.
سلولهای ثانویه ("مرطوب")
این نوع سلول (به دلیل استفاده از الکترولیت مایع به آن مرطوب گفته می شود ) جریان را از طریق یک سلول ثانویه در جهت مخالف سلول اول / طبیعی تولید می کند. این باعث می شود که عمل شیمیایی به صورت معکوس انجام شود ، و به طور موثری ترمیم شود ، به این معنی که قابل شارژ شدن هستند .این باتری ها می توانند گران تر باشند اما زباله کمتری تولید می کنند زیرا می توان چندین بار از آنها استفاده کرد.برای تهیه ی الکترولیت ( مخلوط آب و اسید ) باتری های سرب اسیدی از آب مقطر استفاده میشود . آب مقطر را از تقطیر آب طبیعی به دست می آورند که در حین تقطیر ، املاح موجود در آب از آن جدا می شود . آب طبیعی را به دلیل داشتن خواص گوناگون ناشی از وجود املاح نمی توان در تهیه ی الکترولیت استفاده نمود .
پژوهشگر و نویسنده: دکتر ( افشین رشید)
دکترایِ تخصصی نانو _ میکرو الکترونیک