_ بخش باتری ها و پیل های اِلکتریکی
بررسی " باتری یون لیتیم "
پژوهشگر و نویسنده: دکتر ( افشین رشید)

باتری لیتیومی یا باطری لیتیومی یکی از وسایل حفظ و ذخیره ی انرژی الکترونیکی است. بیشترین کاربرد باتریهای لیتیومی در گوشیهای موبایل، مودم های اینترنت و تلفنهای شارژی است.
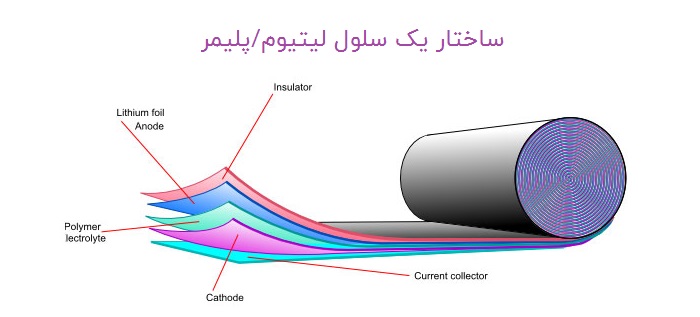
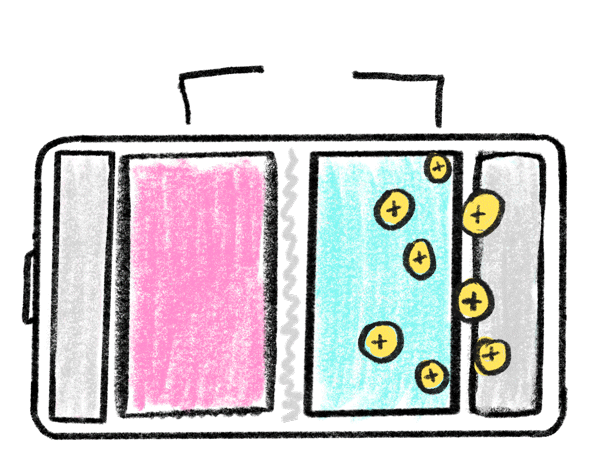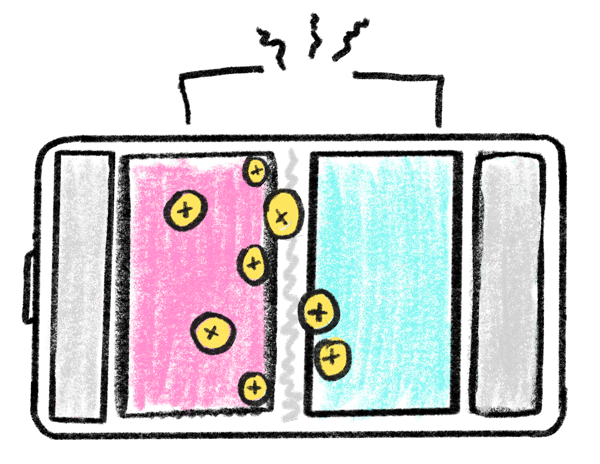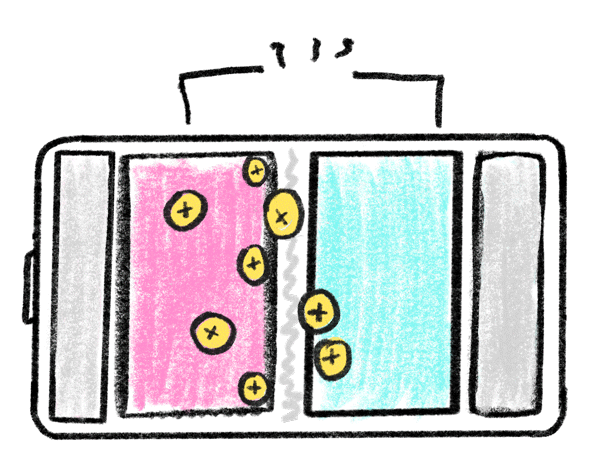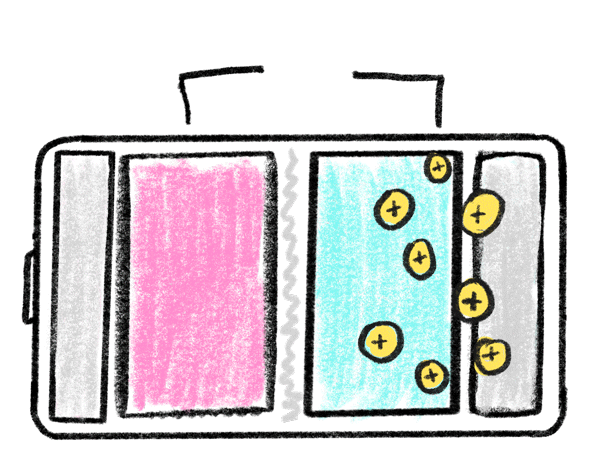
باتری های لیتیومی همانند باتری ها و مولد های دیگر از سه بخش اصلی تشکیل شده است: الکترود منفی، الکترود مثبت و ماده ای شیمیایی به نام الکترولیت تشکیل شده است. عملکرد این باتری های از طریق جا به جایی یونی اتفاق میافتد و به همین دلیل است که به این باتریها لیتیوم یون یا لیتیوم یونی نیز می گویند.
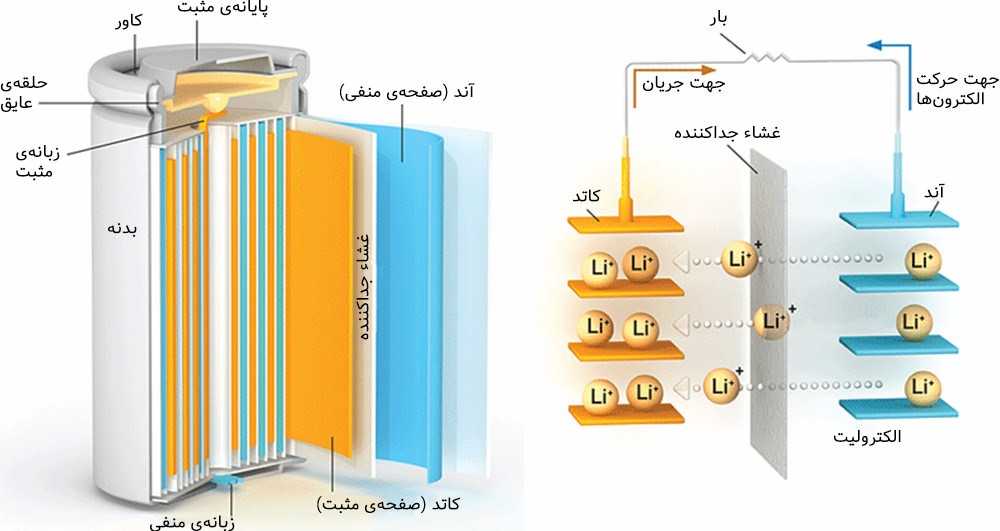
اکثر باتری های لیتیومی در محفظههای خاصی شارژ می شوند. این محفظه ها یا به خود باتری متصل اند و یا به صورت جدا باید آن ها را خریداری کنید؛ برای شارژ این باتری ها کافیست باتری یا محصول را در این محفظه ها قرار بدهید. باتری های لیتیومی با توجه به کاربرد و استفاده های مختلف، ولتاژهای متفاوتی دارند. رایج ترین ولتاژ باتری های لیتیوم آیون 3.7 ولت است که این باتری با ولتاژ شبیه به باتری " خشک ساده یا آلکالاین " است. با وجود اینکه باتریهای لیتیوم پلیمر عمر و زمان استفاده مشخصی دارند. اما با مراقبت درست از آن ها می توان طول عمر آن ها را افزایش داد. یکی از روش های کارآمدی برای حفظ طول عمر باتری شارژ کردن به موقع و از شارژ درآوردن به موقع آن است. باتری های لیتیوم پلیمری کاربرد های متفاوتی دارند. با توجه به شکل پذیری این باتری ها می توان آن ها را در ابعاد و اشکال مختلف تولید کرد. این باتری ها وزن کمی دارند و فضای کمی را نیز اشغال می کنند؛ به همین دلیل این باتری های را در ماشین های کنترلی و کنترل شونده های از راه دور استفاده می کنند. یکی دیگر از کاربرد های این باتری ها استفاده در وسایل الکترونیکی شخصی مانند پاور بانک، گوشی موبایل و تبلت است. این باتری های ظرفیت های متفاوتی از 200 تا 20000 میلی آمپر را پشتیبانی می کنند و به همین دلیل است که باتری های لیتیوم آیون انتخاب ایده آلی در دنیای مولد ها هستند.
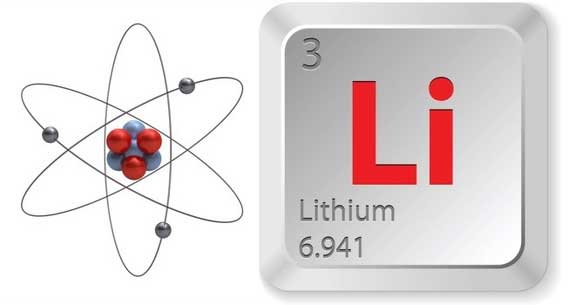
لیتیم با نماد شیمیایی Li یک فلز قلیایی نقره ای – سفید و نرم با عدد اتمی ۳ است. این عنصر در شرایط استاندارد دما و فشار سبک ترین فلز و کم چگالی ترین عنصر جامد است. مانند دیگر فلز های قلیایی ، لیتیم هم بسیار واکنش پذیر و آتشگیر است به همین دلیل بیشتر آن را زیر روغن صنعتی و یا نفت نگاه میدارند. اگر بر روی آن برشی پدید آید بخش بریده شده دارای جلای فلزی خواهد بود اما به دلیل واکنش پذیری زیاد آن خیلی زود با رطوبت هوا واکنش می دهد، هوا باعث خوردگی آن می شود و به رنگ نقره ای تیره مایل به خاکستری و سپس سیاه در می آید.به دلیل واکنش پذیری بالای لیتیم، هرگز نمی توان آن را به صورت عنصر آزاد در طبیعت پیدا کرد بلکه همواره در بخشی از یک ترکیب شیمیایی که بیشتر یونی است، پیدا می شود. لیتیم در تعدادی از کانی های پگماتیتی یافت می شود.
نانو ذرات به دلیل کاربرد گسترده آنها ، هم در صنعت و هم در علوم طبیعی بسیار مورد توجه هستند. در حالی که مواد طبیعی بدون در نظر گرفتن اندازه دارای خصوصیات فیزیکی ثابت هستند ، اندازه یک ذره نانو خصوصیات فیزیکی و شیمیایی آن را تعیین می کند. بنابراین ، خصوصیات یک ماده با نزدیک شدن اندازه آن به مقیاس نانو و قابل توجه شدن درصد اتم در سطح ماده ، تغییر می کند.ویژگی مهم همه ی نانو ساختارهای آنست که تعداد اتم های سطح در آن ها نسبت به تعداد اتم های حجم بیشتر است. این نسبت با کاهش اندازه ی نانو ذره افزایش می یابد. بنابراین اندازه ی نانو ذره ویژگی مهم آن محسوب می شود.بازه ی تغییر فعالیت نانو ذرات به ماهیت و شکل نانو ساختار بستگی دارد. با این حال، اگر انرژی میدان نانو ذره با انرژی پرتودهی الکترو مغناطیسی قابل قیاس باشد و اگر در محدوده ی معین طول موج با رخداد واکنش های شیمیایی در مواد تحت پرتودهی تغییرات چشمگیر ایجاد گردد فعالیت نانو ذره های تا اندازه ی 100nm چشمگیر خواهد بود.اتم های سطح نانو ذرات از لحاظ انرژی جبران نشده اند. بطور کلی، نتایج رشد انرژی نانو ذره را می توان بصورت انرژی کل اتم های سطح ذره بیان نمود. آزادی جنبش اتم های سطح نانو ساختار ها محدود است و تنها جنبش های ارتعاشی و حرکت الکترون ها امکان پذیر می باشد. این دو واکنش الکترو جنبشی به یکدیگر وابسته اند چون جابجایی ابرهای الکترونی اتم ها بطور حتم بسامدهای ارتعاشی پیوندهای اتم های نانو ذرات را تغییر می دهد. از طرف دیگر، تغییر مکان الکترون های ظرفیت در پیوند ها قطبیت پیوند و اجسام موسوم به ابر مولکول را تغییر می دهد. در این صورت انتقال الکترون به سطح انرژی بالاتر امکان پذیر می شود.
پژوهشگر و نویسنده: دکتر ( افشین رشید)
دکترایِ تخصصی نانو _ میکرو الکترونیک