کپی لینک
_ بخش باتری ها و پیل های اِلکتریکی
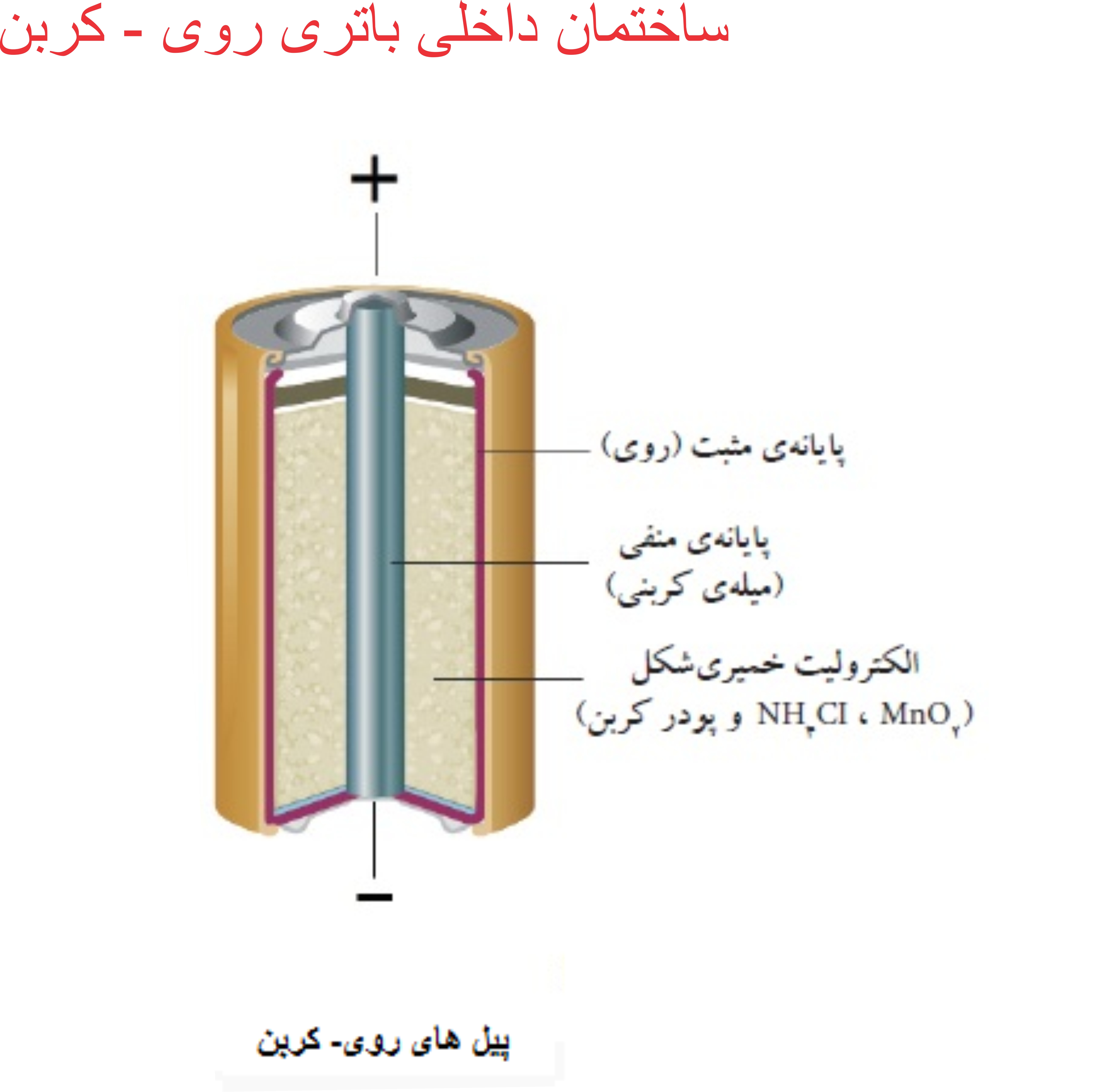
ساختار و ساختمان داخلی " باتری روی - کربن "
پژوهشگر و نویسنده: دکتر ( افشین رشید)
نکته : باتری روی - کربن از خانواده باتری های خشک و باتری هایی غیرقابل شارژ هستند که پس از تخلیه ی قطب منفی آن دیگر قادر به تولید انرژی نیستند.
باتری روی _ کربن دارای بدنه ای فلزی از جنس روی است و درون آن را خمیر آمونیوم کلرید یا زینک کلرید تشکیل می دهد. این خمیر همان الکترولیت باتری است. قسمت کربن این باتری در تماس با الکترولیت است چرا که فلزات متداول در تماس با خمیر نمکی به سرعت خورده می شوند.این باتری قلمی در دمای بالا از کار میافتد و دیگر نمی تواند انرژی تولید کند اما می توان این باتری را منجمد کرد و زمانی که می خواهید از آن استفاده کنید با رساندن دمای آن به دمای اتاق از آن استفاده کرد.

در ساختمان داخلی باتری روی - کربن اسید شروع به خوردن روی می کند. حباب های هیدروژن روی میله ظاهر می شود و محلول در اثر حرارت حاصل از واکنش شیمیایی، گرم خواهد شد. آن چه روی می دهد، تقریباً به ترتیب زیر است:
• مولکول های اسید به سه یون تفکیک می شوند: دو یون +H و یک یون -SO42 .
• اتم های روی دو الکترون از دست می دهند و به یون های Zn2+ تبدیل می شوند.
• یون های+Zn2 با یون های -SO42 ترکیب شده و به صورت ZnSO4 درمی آید، که در اسید حل می شود.
• یون های هیدروژن الکترون هایی را که اتم های روی از دست داده اند، جذب می کنند و به صورت مولکول H2 ( گاز هیدروژن ) در می آیند. این همان حباب ها یی است که روی میله ظاهر می شود.
باتری روی _ کربن از یک یا چند سلول الکتروشیمیایی کوچک داخلی تشکیل شده اند. همچنین هر سلول دارای دو نیم سلول است. باتری ها برای کارکرد، به چندین واکنش شیمیایی نیاز دارند. در حقیقت، حداقل یک واکنش شیمیایی در درون یا نزدیکی آند و یک یا چند واکنش شیمیایی در درون یا نزدیکی کاتد اتفاق می افتد. انتقال یون ها میان واکنش های انجام شده در قطب های آند و کاتد بر عهده الکترولیت است. به بیان ساده تر، مبانی باتری ها بر اساس یک واکنش شیمیایی (واکنش اکسایش _ کاهش) کار می کند. لازم به ذکر است که نیم واکنش اکسایش، در آند (الکترون های اضافی تولید می شود) و نیم واکنش کاهش، در کاتد (استفاده از الکترون های اضافی) رخ می دهد.دو الکترود کاتد و آند در الکترولیت غوطه ور می باشند. در اینجا، یون ها در اثر واکنش شیمیایی اکسایش، میان الکترولیت و آند آزاد می شوند. الکترون ها در محلول الکترولیت حرکت می کنند. با حرکت الکترون ها، جریان الکتریکی ایجاد خواهد شد. در واقع با انباشته شدن الکترون ها در اطراف آند، آنها از طریق سیمی که میان آند و کاتد گذاشته شده است، به سمت کاتد حرکت می کنند. این حرکت الکترون ها سبب بوجود آمدن جریانی الکتریکی می گردد که در نهایت می تواند برق دستگاه های متصل به این سیم را تامین نماید.
پژوهشگر و نویسنده: دکتر ( افشین رشید)
دکترایِ تخصصی نانو _ میکرو الکترونیک


